On appelle isomères des composés ayant même formule brute mais qui diffèrent par :
- l’enchaînement des atomes (isomérie de constitution)
- la disposition des atomes dans l’espace (stéréochimie)
I- Isomérie de Constitution
I.1- Isomérie de chaîne (squelette)
Ils ont même groupement fonctionnel, mais diffèrent par l’enchaînement des atomes de carbone du squelette carboné. Leurs propriétés chimiques sont identiques mais leurs propriétés physiques, elles, sont différentes.
Exemple : Formule Brute C4H10
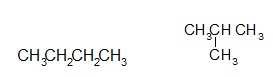
Butane 2-méthylpropane (Isobutane)
I.2-Isomérie de position
Ils ont même fonction, même squelette carboné. Ils ne diffèrent que par la position du groupe fonctionnel ou de la liaison multiple. Leurs propriétés physiques sont différentes et leurs propriétés chimiques sont légèrement différentes.
Exemple : Formule brute C3H8O
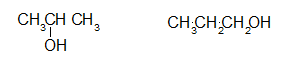
Propan-2-ol Propan-1-ol
I.3- Isomérie de fonction
Ils diffèrent par le groupement fonctionnel. Les propriétés physiques et chimiques sont rigoureusement différentes.
Exemple : Formule brute C3H8O

Propan-1ol 1-méthoxyéthane
I.4- Tautomérie La tautomérie est une sorte d’isomérie dynamique. Il s’agit d’un équilibre chimique entre 2 composés. La prototropie est le cas le plus courant (migration d’un hydrogène). Exemple : l’équilibre céto-énolique de l’acétone est l’exemple le plus courant. 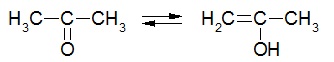
II- Stéréochimie
Les isomères de même constitution (même formule développée plane) qui ne diffèrent que par la disposition spatiale de leurs atomes sont appelés stéréoisomères.
Il existe deux types de stéréoisomères :
- les stéréoisomères de conformation
- les stéréoisomères de configuration
II.1- Stéréoisomérie de conformation
Les stéréoisomères de conformation ne différent que par simple rotation autour d’une liaison simple. Ces conformations ne sont pas séparables à température ambiante.
II.1.1- Etude de l’éthane
La liaison simple entre les 2 atomes de carbones d’hybridation sp3 permet la rotation des atomes d’hydrogène autour de cette dernière. Cette rotation n’est pas totalement libre. En effet, il y a gêne stérique lorsque 2 liaisons C-H se trouvent face-à-face. Cette gêne ne stoppe pas la rotation, mais la conformation concernée est déstabilisée. Il y a une infinité de conformations.
L’analyse conformationnelle est l’étude des variations d’énergie associées à la rotation des groupes autour d’une liaison simple. Cette analyse a pour but de déterminer les conformations énergiquement favorisées. La représentation de Newman facilite cette étude.
On définit l’angle dièdre θ l’angle de rotation de la liaison simple.
De cette étude se dégage deux conformations particulières :
- éclipsée/antipériplanaire : les hydrogènes des deux carbones se font face (θ = 0°)
- décalée/synpériplanaire : les hydrogènes sont les plus distants possibles (θ = 60°)
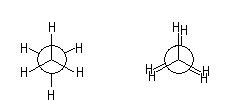
Décalée Eclipsée
La variation de l’énergie potentielle de l’éthane en fonction de l’angle dièdre est donnée ci-dessous :
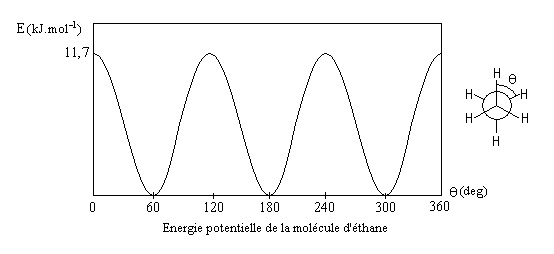
L’énergie potentielle est maximale dans le cas de la conformation éclipsée et minimale dans le cas de la conformation décalée. En effet, dans le cas de la conformation décalée, les doublets de liaisons C-H sont à une distance maximale, la répulsion entre doublets électroniques est donc minime.
On appelle conformère la conformation de plus basse énergie potentielle (la plus stable).
La conformation éclipsée représente la barrière de rotation de l’éthane. L’énergie associée à cette conformation correspond à l’énergie d’activation de Gibbs (Ea), énergie nécessaire pour atteindre la conformation instable « état de transition ».
Pour qu’une rotation soit possible, il faut que le maximum d’écart énergétique entre les deux états soit inférieur à 25 kcal.mol-1.
II.1.2- Cas du butane
L’étude se porte cette fois sur la liaison C2-C3. On néglige les rotations des autres liaisons C-C.
On retrouve ici également les deux conformations particulières éclipsées et décalées. Dans le cas de la conformation décalée, on distinguera la conformation décalée gauche (θ = 60°) et décalée anti (θ = 180° entre les deux méthyles).

Décalé anti Décalé gauche
La figure suivante représente la variation de l’énergie potentielle de la molécule en fonction de l’angle dièdre entre les deux groupements méthyles.
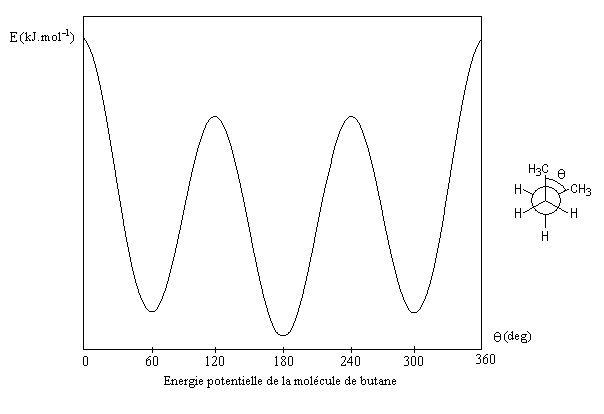
Il résulte de cette étude que la conformation décalée anti est la plus stable, donc la plus abondante.
II.2- Stéréoisomérie de Configuration
Deux stéréoisomères dont le passage de l’un à l’autre ne peut se faire sans rupture d’une liaison sont dits stéréoisomères de configuration.
Ces stéréoisomères se classent en deux catégories :
- les énantiomères : deux stéréoisomères images l’un de l’autre dans un miroir.
- les diastéréoisomères qui ne sont pas énantiomères.
II.2.1- Chiralité
La chiralité est la propriété d’un objet de ne pas être superposable à son image dans un miroir.
Par définition, toute molécule dépourvue d’axe alternant (noté Sn) est nécessairement chirale et peut donner naissance à l’isomérie optique ou énantiomérique.
Un axe alternant résulte d’une opération de symétrie par rotation d’ordre n suivie d’une symétrie par rapport à un plan perpendiculaire à l’axe Cn.
L’axe de symétrie Cn correspond à un axe de rotation 2π/n
S1 : plan σ
S2 : Ci (centre d’inversion)
De plus, une molécule contenant 1 axe Cn et n axes C2 est également chirale.
Il existe deux types de chiralité :
- chiralité dissymétrique si présence d’un axe de symétrie hors axe alternant
- chiralité asymétrique si absence totale d’élément de symétrie
II.2.2- Pouvoir rotatoire
Généralement deux énantiomères ont des propriétés physiques et chimiques identiques, ils ne diffèrent que par le pouvoir rotatoire (activité optique).
Lorsqu’un rayon de lumière polarisée plane traverse une solution contenant une molécule chirale, le plan de polarisation effectue une rotation.
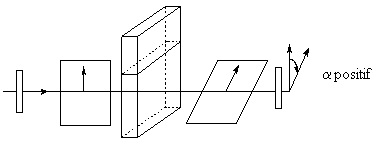
1 2 3 4 5 6
1 : 1er polariseur et sens de polarisation
2 : Plan de polarisation
3 : solution de composé actif
4 : plan dévié
5 : polariseur mobile rotatif
6 : plan dévié de α degrés pour l’observateur situé à droite
Un des énantiomères dévie ce plan d’un angle α vers la droite, il est qualifié de dextrogyre, noté d ou (+). L’autre énantiomère déviera ce même plan vers la gauche, il est alors qualifié de lévogyre, noté l ou (-).
L’angle est mesuré à l’aide d’un polarimètre. Le pouvoir rotatoire [α] est défini par la loi de Biot :
Le pouvoir rotatoire [α]λ,T est défini par la loi de Biot :
α = [α]λ,T.l.C
[α]λ,T : pouvoir rotatoire spécifique mesuré en degrés
l : largeur de la cuve (trajet optique) en dm
C : concentration de substance active en g.mL-1
Un pouvoir rotatoire est déterminé pour une longueur d'onde λ et une température T.
II.2.3- Eléments de chiralité
Il existe 4 types d’éléments de chiralité :
- le centre de chiralité
- l’axe de chiralité
- le plan de chiralité
- l’hélicité
Une molécule possédant un seul élément de chiralité est nécessairement chirale. Au-delà, il faut chercher la présence ou non d’axe alternant. Une molécule possédant plusieurs éléments de chiralité n’est pas nécessairement chirale.
II.2.3.1- Centre de chiralité
Il s’agit d’un atome tétraédrique ou pyramidal (C, N, Si, P,…) comportant 4 substituants différents. Le plus courant en chimie organique est le carbone asymétrique, noté C*.
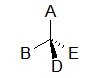
où A ≠ B ≠ D ≠ E
Dans le cas de l’azote, le phénomène d’inversion interconvertit rapidement et en permanence les deux énantiomères. Ces deux énantiomères sont inséparables.
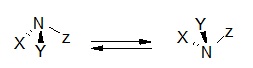
La possibilité de séparer des énantiomères dépend de la vitesse d’inversion de l’atome considéré. Les énantiomères des amines tertiaires (NR3) ne sont séparables que dans quelques cas bien particuliers. La présence de substituants autres que l’hydrogène sur les phosphines (PR3) et arsines (AsR3) permet en général la séparation de ces derniers.
II.2.3.2- Axe de chiralité
Il résulte de la dissymétrisation complète d’un axe de symétrie décrit par l’intersection de 2 plans. C’est le cas des allènes, biphényles et spiranes.
Exemples :
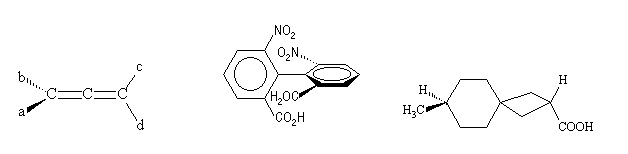 a ≠ b et c ≠ d
a ≠ b et c ≠ d
Allène Biphényle Spirane
II.2.3.3- Plan de chiralité
Le plan de chiralité contient le plus grand nombre d’atomes de la molécule considérée. La chiralité est due à la présence d’atomes hors de ce plan.
Exemple : Un des exemples les plus fréquents pour mettre en évidence le plan de chiralité est le cyclooctène E. Le plan de chiralité est le plan contenant la double liaison.
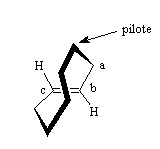
Pour nommer un plan de chiralité, on recherche hors du plan l’atome le plus proche de celui-ci. Cet atome est appelé atome pilote. On considère ensuite les 3 atomes adjacents dans le plan. S’ils sont plusieurs, on prend les prioritaires. Si la séquence vue du pilote tourne selon les aiguilles d’une montre, le plan est dit pR, sinon il est qualifié de pS.
II.2.3.4- Hélicité
Pour les molécules comportant un enroulement hélicoïdal (hélicènes), les énantiomères correspondent aux deux sens d’enroulement de l’hélice. On nomme P (+) pour l’hélice de pas droit et M (-) pour l’hélice de pas gauche.
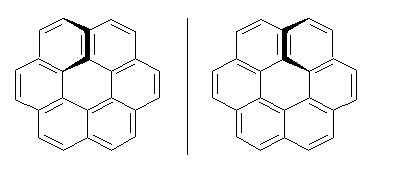
P M
II.2.4- Règles de Cahn, Prelog et ingold
L’ensemble des règles permettant de nommer les énantiomères a été proposé par Cahn, Prelog et Ingold. Cet ensemble de règles porte le nom de règle des séquences. Elles ont pour but de classer les substituants par ordre de priorité décroissante.
Cette règle concerne en premier lieu le centre de chiralité. Les 4 substituants (a, b, c et d ) d’un centre de chiralité sont classés dans un ordre de priorité fixé par la règle des séquences. Si, en regardant dans la direction du centre de chiralité vers le plus petit substituant (par exemple d), on suit la séquence a, b, c dans le sens des aiguilles d’une montre, ce centre est dit R (Rectus). Dans le cas inverse, il est nommé S (Sinister).
La règle des séquences est constituée de 5 sous-règles dont l’ordre est à suivre rigoureusement.
N°1 : La priorité de l’atome du substituant directement lié au centre augmente quand le numéro atomique Z augmente (I > Br > Cl > F > O > N > C > H > doublet libre (Z = 0)).
Si deux ou plusieurs atomes immédiatement directement lié au centre chiral (1er rang) sont identiques, on les départagera en appliquant la règle précédente aux atomes du 2ème rang, et ainsi de suite.
Exemples : -CH2CH3 -CH3
I II
|
Groupe |
I |
II |
|
rang 1 |
(C, H, H) |
(H, H, H) |
Le groupe I est prioritaire sur le groupe II.
-CH2CH(CH3)2 -CH2CH2CH3
I II
|
Groupe |
I |
II |
|
1er rang |
(C, H, H) |
(C, H, H) |
|
2ème rang |
(C, C, H) |
(C, H, H) |
Le groupe I est prioritaire sur le groupe II.
Si le long d'une chaîne on atteint un endroit ou il y a une bifurcation sans pouvoir conclure, on choisit un chemin prioritaire correspondant à l'atome prioritaire des deux séries identiques.
Exemple :
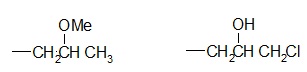
I II
Au 1er rang, on a deux séries (O, C, H) identiques, on ne peut pas conclure. On compare alors les branches prioritaires correspondant à la bifurcation vers l'atome d'oxygène. Le groupement I est prioritaire sur le II car l'atome de carbone l'emporte sur l'atome d'hydrogène.
Les liaisons multiples sont ouvertes en liaisons simples. On attache à chaque atome une réplique de l'atome qui lui est lié jusqu'à saturer sa valence. Ces répliques d’atomes sont elles-mêmes liées à des « atomes fantômes». Par convention, un atome fantôme a pour numéro atomique Z = 0.
Exemple : 
I II
|
Groupe |
I |
II |
|
1er rang |
C (O, O, H) |
C(C, C, H) |
N°2 : La priorité augmente avec le nombre de masse A dans le cas des isotopes (T>D>H).
N°3 : Un enchaînement Z précède un enchaînement E.
Z E
N°4 : Les groupements RR ou SS précèdent les groupes SR ou RS.
N°5 : La configuration R est prioritaire sur la configuration S.
Les 4 premières sous-règles concernent d’authentiques centres de chiralité. La 5ème sous-règle concerne les composés inactifs optiquement ou achiraux (méso). On parle de carbone pseudo-asymétrique (noté s ou r).
Important :
En cas de présence d’un axe de chiralité, la dénomination de cet axe est prioritaire par rapport à celle du centre de chiralité. C’est la sous-règle 0.
- On regarde la molécule selon l’axe de chiralité.
- Un substituant « avant » sera prioritaire sur un substituant « arrière ».
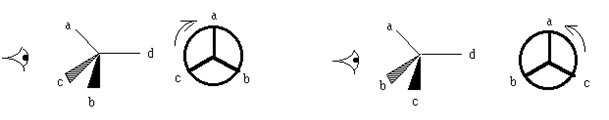
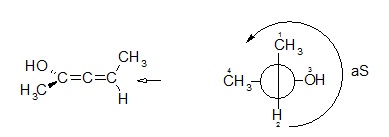
On suit la séquence dans l’ordre des substituants décroissants, en partant du prioritaire et en finissant par le plus petit. Par analogie au centre de chiralité, lorsque la séquence tourne dans le sens des aiguilles d’une montre, on parle d’axe aR, dans le cas contraire on le nommera aS.
Exemple :
II.2.5- Diastéréoisomérie
Une molécule possédant n éléments de chiralité possède 2n configurations différentes au maximum, énantiomères deux à deux.
Deux stéréoisomères qui ne sont pas énantiomères sont diastéréoisomères. Ils peuvent être chiraux ou non. Leurs propriétés physiques étant différentes, il est facile de les séparer.
Il existe deux types de diastéréoisomères :
- diastéréoisomères σ
- diastéréoisomères π
II.2.5.1- Diastéréoisomérie σ
C’est le cas des molécules possédant n atomes asymétriques (n>1).
Exemple : Cas du 2,3-dicloropentane
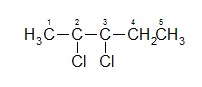
Présence de 2 carbones asymétriques (C2 et C3) : 4 Stéréoisomères.
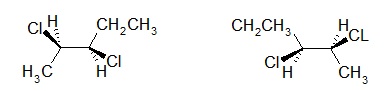
2R,3R 2S,3S
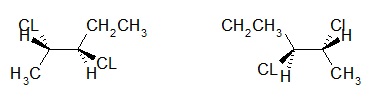
2S,3R 2R,3S
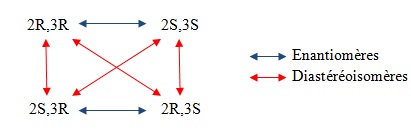
Deux diastéréoisomères qui se distinguent par la configuration d’un seul élément de chiralité sont des épimères.
Si la molécule est de constitution symétrique, le nombre de stéréoisomères restants est déterminé de la façon suivante (pour n atomes asymétriques) :
- Si n est pair, on aura 2n-1 + 2n/2+1 stéréoisomères.
- Si n est impair, on aura 2n+1 configurations différentes.
II.2.5.2- Diastéréoisomérie π
Il s’agit de la diastéréoisomérie éthylénique. Il y a deux configurations possibles : Z (Zusammen) et E (Entgegen).
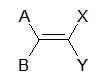
A ≠ B et X ≠ Y
Si A>B et X>Y, on parle de configuration Z.
Si A>B et Y>X, on parle de configuration E.
Les substituants sont classés selon la règle des séquences.
Exemple :
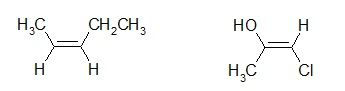
CH3>H et CH2CH3>H OH>CH3 et Cl>H
Z E
