I- Effets électroniques
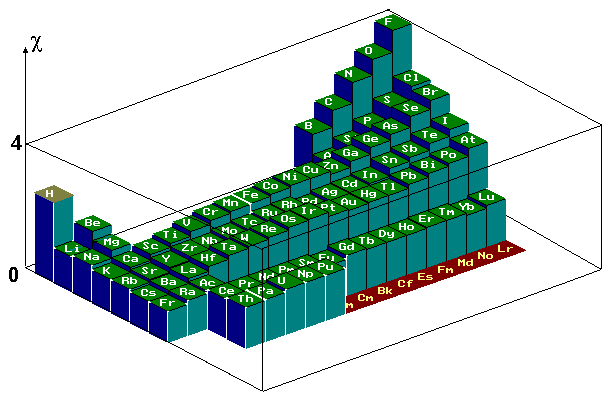
I.1- Electronégativité
L’électronégativité représente l’affinité d’un noyau pour ses électrons, ainsi que sa capacité à les capturer et les retenir. Cette grandeur permet de prédire :
- le degré d’oxydation d’un élément
- la nature des liaisons covalentes (polaire, apolaire ou de coordination)
- la nature des éléments (métaux ou non métaux)
L'électronégativité croit de bas en haut et de gauche à droite. L’élément le plus électronégatif est le fluor et le moins électronégatif est le francium.
L’échelle couramment utilisée est l’échelle de Pauling. On pose de façon arbitraire χF = 4,0. Les autres grandeurs sont déterminées de proche en proche.
I.2- Polarisation des liaisons covalentes
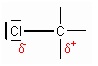
Si les deux atomes sont différents, celui qui a la plus forte électronégativité va attirer le nuage électronique vers lui. La liaison est alors polarisée et on a apparition de charges partielles (formelles), à ne pas confondre avec les charges totales (+) et (-). L’électronégativité permet d’identifier les charges partielles des atomes formant une liaison. On représente ces charges par les symboles δ+ (charge partielle positive) et δ- (charge partielle négative) d’une liaison. L’atome le plus électronégatif d’une liaison porte la charge partielle négative.
Exemple :
I.3- Effet inductif
L’effet inductif rend compte du déplacement du nuage électronique, à travers la liaison σ.
- L’atome le plus électronégatif va attirer une partie du nuage électronique de la liaison. On parle d’effet attracteur –I.
- L’atome le plus électropositif va repousser une partie du nuage électronique de la liaison. On parle d’effet répulsif +I.
|
Effet –I Substituants attracteurs d’électrons |
Effet +I Substituants répulsifs d’électrons |
|
Halogènes (F > Cl > Br > I) OH > OR CHO > C=O >CO2R NH2 NO2 > CN |
Groupements alkyles (Me, Et, iPr, tBu) Métaux |
La polarisation et l’effet inductif qui y est lié jouent un rôle important dans la réactivité des molécules.
I.4- Effet mésomère
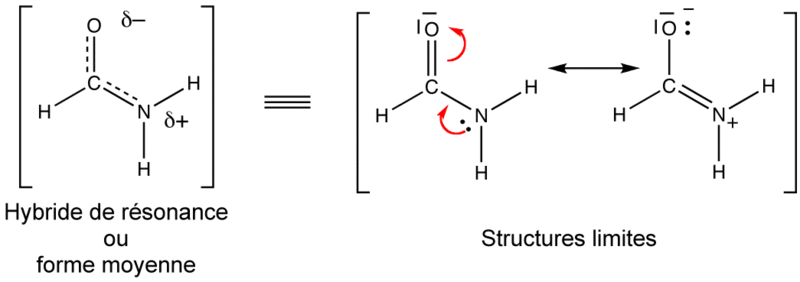
L’effet mésomère correspond à la délocalisation des électrons π et n (non liants). La délocalisation des électrons est représentée par l’équilibre mésomérique, en utilisant les formules de Lewis.
Chaque représentation est une forme limite de la molécule. L'équilibre mésomérique entre deux formes limites est représenté par une double flèche. Les formes limites (ou de résonance) n’existent que sur le papier. La description correcte d’une telle molécule est une forme moyenne, sur laquelle les doublets non liants ne sont pas indiqués, les positions des électrons π sur les liaisons sont représentées en pointillé.
Comme pour l'effet inductif, le sens de l'effet mésomère sera compté positif (+M) s'il apporte des électrons vers le centre étudié, négatif dans le cas contraire (-M).
Les règles à respecter pour écrire les formes mésomères limites sont les suivantes :
- respecter la valence des atomes
- respecter la charge globale de la molécule.
- cas des systèmes conjugués : seuls les électrons π, n et les orbitales vacantes peuvent être déplacées.
Exemple :
On parle de système conjugué lorsque les électrons π, n, les orbitales vacantes, ou les électrons célibataires ne sont séparés que par une simple liaison et une seule. Important : II- Classement des réactifs et des réactions II.1- Définitions – Formalisme II.1.1- Définitions Une réaction chimique en chimie organique résulte de l’attaque d’un substrat (composé sur lequel la réaction va avoir lieu) par un réactif, pour former un produit. Parfois on peut obtenir avec le produit un groupe partant, appelé nucléofuge, provenant du substrat. On symbolise une réaction par une équation bilan : Substrat + Réactif = Produit (+ Nucléofuge) Un mécanisme réactionnel décrit la suite des différentes étapes, l’enchaînement des étapes élémentaires d’une réaction chimique. Il va décrire avec précision les états de transition, les ruptures et formations des liaisons et l’ordre dans lequel cela s’effectue. II.1.2- Formalisme Lors de l’écriture d’un mécanisme réactionnel, on symbolise par des flèches le déplacement des électrons. La pointe de la flèche est orientée vers l’atome qui reçoit les électrons. Le déplacement d’un doublet d’électrons est représenté par une flèche
Le déplacement d’un seul électron est représenté par une demi-flèche
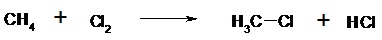
II.1.3- Rétrosynthèse La coupure d’une liaison est représentée par le symbole Le passage d’une étape hypothétique à une étape antérieure est symbolisé par une flèche Exemple : II.2-Types de Réactifs II.2.1- Réactif électrophile Possède un site pauvre en électron, qui attire les électrons. Il réagit avec les sites riches en électrons. Il possède une charge positive ou une orbitale vacante. Les acides de Lewis font partie des électrophiles. Exemples : Carbocation (C+), AlCl3, BH3, Na+ II.2.2- Réactif nucléophile Possède un site riche en électrons, donneur d’électrons. Il réagit avec les sites pauvres en électrons en donnant une paire d’électrons. Il possède une charge négative et/ou une paire d’électrons non liants. Les bases de Lewis font partie des nucléophiles. Exemples : Carbanion (C-), R-NH2, R-OH, OH- II.3- Classement des réactions Hormis les réactions habituelles acido-basiques et d’oxydoréduction, il existe quatre types de réactions en chimie organique : - Substitution - Addition - Elimination - Réarrangement II.3.1- Réactions de substitution Il y a remplacement d’un atome ou groupe d’atomes sur le substrat par un atome ou groupe d’atomes. Trois types de substitutions sont possibles : - Substitution nucléophile (SN)
- Substitution électrophile (SE)
- Substitution radicalaire (SR)
II.3.2- Réactions d’addition Un atome ou groupe d’atomes se fixe sur le substrat. Ce dernier doit posséder une insaturation (liaison double). De façon analogue à la substitution, il existe 3 types d’additions : - Addition nucléophile (AN)
- Addition électrophile (AE)
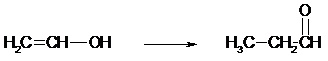
- Addition radicalaire (AR) II.3.3- Réaction d’élimination Elle consiste en la perte d’au moins deux atomes du substrat. C’est le cas de la déshydratation des alcools (perte d’une molécule d’eau).
II.3.4- Réarrangement Certains atomes ou groupes d’atomes changent de place sur la molécule pour former un composé isomère par rapport à celui de départ.
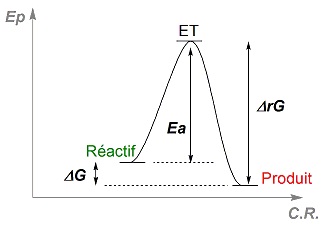
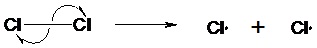
II.4- Aspect énergétique d’une réaction II.4.1- Profil énergétique Une réaction chimique peut se décomposer en plusieurs étapes qualifiées d’actes élémentaires. A l’échelle microscopique, on passe d’une étape à une autre via des chocs entre deux espèces. Lors de ces chocs, le changement de structure se traduit par une évolution de l’énergie potentielle du système. Pour représenter cette évolution énergétique, on trace ce que l’on appelle le profil énergétique décrivant la variation de l’énergie potentielle EP du système lors du passage des réactifs aux produits. En abscisse sont portées les coordonnées de réaction (CR) et en ordonnée EP. La CR est une grandeur monodimensionnelle abstraite traduisant généralement un paramètre géométrique propre à une espèce chimique donnée (longueur de liaison, angle de liaisons, hybridation d’un atome). L’état de transition (ET) est l’état correspondant à l’énergie potentielle maximale, de durée de vie nulle : il est non isolable. On le représente entre crochet par symbole ≠. Un profil énergétique peut aussi mettre en évidence l’existence d’intermédiaires réactionnels (IR). Ces espèces chimiques, contrairement à l’ET, ont une durée de vie variable. Pour qu’un acte élémentaire puisse se réaliser, le système doit franchir une barrière d’énergie : l’énergie potentielle d’activation Ea. La cinétique de réaction dépend de la valeur de cette énergie : plus Ea sera grande, plus la réaction sera lente. II.4.2- Postulat de Hammond La structure de l’état de transition est semblable à la structure du composé dont l’énergie est la plus proche. Dans une réaction exothermique, la structure de l’état de transition sera voisine de celle des réactifs. A l’inverse, la structure de l’état de transition sera semblable à celle des produits dans une réaction endothermique. II.3.4- Contrôle thermodynamique/cinétique Une réaction sous contrôle thermodynamique formera majoritairement le produit le plus stable. Lors d’une réaction sous contrôle cinétique, on obtient majoritairement le produit qui se forme le plus rapidement. II.5- Intermédiaires réactionnels II.5.1- Rupture des liaisons Une rupture d’une liaison covalente est dite homolytique lorsqu’un électron reste attaché à chacun des deux atomes dont il provient. Il s’agit d’une rupture radicalaire : on obtient alors des radicaux libres. Une rupture homolytique est provoquée par chauffage (pyrolyse) ou par irradiation (photolyse). La présence d’une autre molécule peut jouer le rôle d’amorceur de radicaux. Exemple :
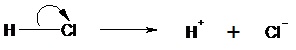
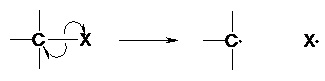
On parle de rupture hétérolytique les deux électrons de la liaison sont transférés sur l’un des deux atomes de la liaison. Il s’agit d’une rupture de type ionique : on obtient des ions. Exemple :
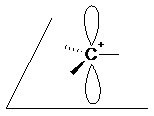
II.5.2- Intermédiaires réactionnels II.5.2.1- Carbocation La structure d’un carbocation est plane (AX3). L’hybridation du carbone est sp².
2 orbitales pz vides Il résulte de la rupture hétérolytique d’une liaison σ, ou de la protonation d’une liaison multiple.
Le carbocation étant pauvre en électron, c’est un électrophile. Sa stabilité croit avec sa classe :
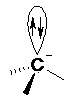
CIIIaire > CIIaire > CIaire II.5.2.2- Carbanion Sa structure est tétraédrique (AX3E). L’hybridation du carbone est de type sp3.
Il est formé par rupture hétérolytique d’une liaison σ par arrachement d’un proton (réaction acido-basique).
Le carbanion étant riche en électrons, c’est un nucléophile. Sa stabilité est inverse de celle du carbocation.
CIIIaire < CIIaire < CIaire II.5.2.3- Radical Sa géométrie est quasiment plane, le carbone a une hybridation sp².
Il est formé par rupture homolytique d’une liaison σ.
Le radical possédant un électron célibataire, il réagit avec d’autres espèces radicalaires.
- Plus une espèce possèdera de formes mésomères limites, plus elle sera stable.
 .
. .
.
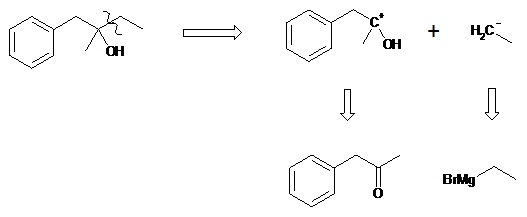
La rétrosynthèse consiste à partir d’une molécule que l’on cherche à synthétiser (molécule cible) et de la couper en fragments de plus en plus simples dont elle est issue, chargés ou non (synthons). Cette étude est purement hypothétique mais permet le rechercher les réactifs permettant la synthèse de la molécule cible. .
. .
.

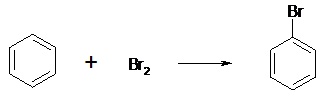
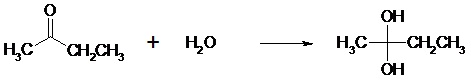
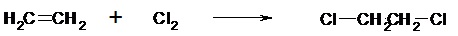

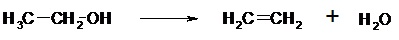
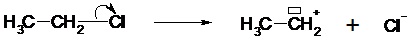
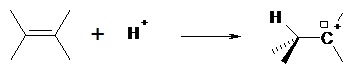
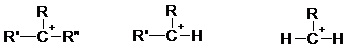

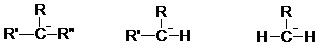
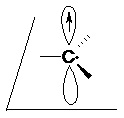
Sa stabilité est du même ordre que le carbocation.
