Préambule
La chimie organique est une branche de la chimie étudiant la structure, les propriétés et la synthèse de composés organiques, c'est-à-dire des molécules à base de carbone.
Un composé est dit organique à partir du moment où il est composé d’au moins 1 atome de carbone lié à 1 atome d’hydrogène.
Les atomes d’une molécule organique autres que le carbone et l’hydrogène sont appelés hétéro-atomes (non métalliques).
I- Liaisons - Géométrie - Hybridation
I.1- Liaison covalente - Règle de l’octet
Les atomes de la famille des non-métaux se lient entre eux par des liaisons covalentes pour former des molécules.
La liaison covalente est issue de la mise en commun d’au moins deux électrons célibataires (de valence) provenant de deux atomes distincts. Une liaison covalente peut être simple, double ou triple.
Le nombre de liaisons covalentes que forme un atome dépend du nombre d’électrons de valence qu’il possède, et donc du nombre d’électrons de valence dont il a besoin pour adopter la configuration la plus stable : c'est la règle de l'octet :
Remarque : cette règle rencontre des exceptions notamment lorsqu’on passe aux éléments chimiques de la 3ème période. Elle est applicable aux éléments des groupes s et p.
I.2- Schéma de Lewis
Le schéma de Lewis est une représentation simplifié, dans laquelle les électrons de valence d’un atome sont représentés par des points. Les paires d’électrons, non liantes ou liantes sont elles représentées par des traits. Ces traits peuvent être localisés sur un atome (doublet non liant) ou entre atomes (doublet liant).
Exemples :
Hydrogène Carbone Azote Oxygène Chlore
1s1 2s2 2p2 2s2 2p3 2s2 2p4 3s2 3p5
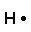
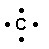
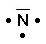
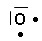
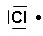
H2O
H : 1 e- de valence x 2 (2 atomes) = 2 e- de valence
O : 6 e- de valence
Total de 8 e- de valence pour la molécule = 4 doublets au total (liants et non liants)
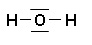
HCN
H : 1 e- de valence
C : 4 e- de valence
N : 5 e- de valence
Total de 10 e- de valence pour la molécule = 5 doublets au total (liants et non liants)
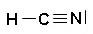
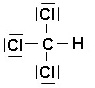
CHCl3
C : 4 e- de valence
H : 1 e- de valence
Cl : 7 e- de valence x 3 = 21 e- de valence
Total de 26 e- de valence pour la molécule = 13 doublets au total (liants et non liants)
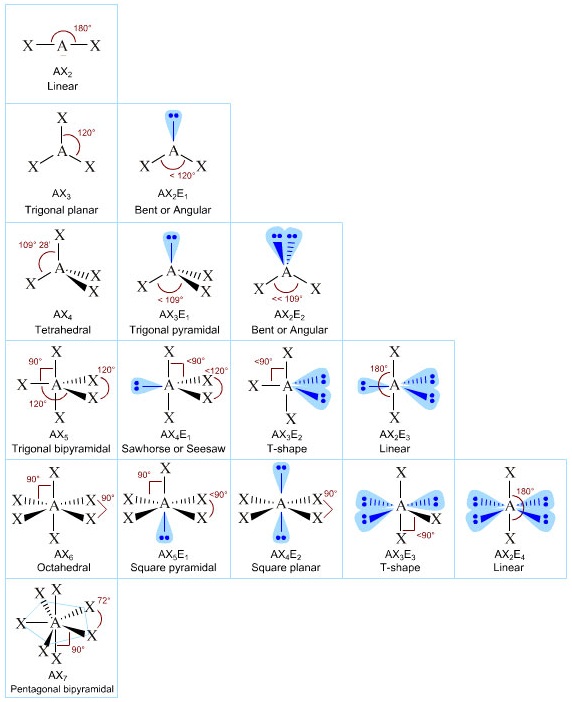
I.4- Géométrie-VSEPR
Le schéma de Lewis n’apporte pas d’élément sur la géométrie des molécules. Les règles de Gillepsie (1957), fondées sur le modèle de la VSEPR (Valence Shell Electron Pair Repulsion), permettent de prévoir l’orientation des liaisons dans l’espace.
La formule générale utilisée dans ce modèle est la suivante :
AXnEm
A : atome central
X : atomes périphériques
E : doublets non liants portés par l’atome central
n : nombre d’atomes périphériques
m : nombre de doublets non liants de l’atome central
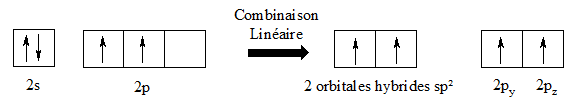
I.5- Hybridation des orbitales atomiques
La théorie de l’hybridation des orbitales atomiques a été développée par Linus Pauling pour expliquer la géométrie des molécules, notamment du méthane. La théorie de l’hybridation va de paire avec le modèle de la VSEPR.
I.5.1- Hybridation sp3
La configuration électronique du carbone ne permet pas d’expliquer la tétravalence du carbone dans le méthane (tétraèdre).
Cette géométrie peut s’expliquer par l’hybridation sp3 des orbitales atomiques du carbone.
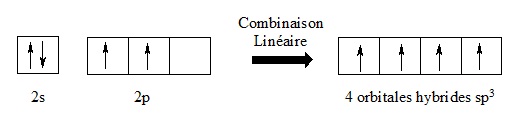
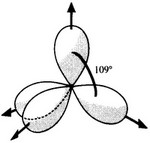
Les quatre électrons qui se trouvaient dans les sous-couches 2s et 2p se retrouvent répartis de façon uniforme dans chacune des quatre orbitales atomiques hybrides sp3. Ils se positionnent alors dans 4 directions faisant entre elles, deux à deux, des angles de 109°28’.
I.5.2- Hybridation sp²
Bien que l’hybridation sp3 soit l’état électronique le plus commun du carbone, ce n’est pas le seul cas possible.
C’est par exemple le cas dans la molécule d’éthylène (H2C=CH2). Il s’agit d’une molécule plane, avec une double liaison résultant de la mise en commun de quatre électrons.
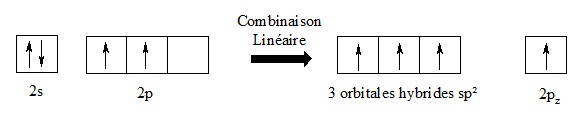
L’orbitale s se combine avec deux orbitales p, pour conduire à trois orbitales hybrides sp². Il reste une orbitale pz inchangée.
La façon de répartir dans l’espace trois électrons de manière à minimiser les répulsions inter-électroniques obéit à une géométrie plane, avec un angle de 120° entre chacune des directions.
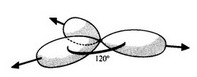
L’orbitale pz n’étant pas touchée par l’hybridation, elle occupe une direction perpendiculaire au plan contenant les trois orbitales hybrides sp². Cette orbitale contient également un électron et pourra intervenir dans la formation de liaisons.
Lorsque deux carbones hybridés sp² se rapprochent, ils peuvent former une liaison σ forte par recouvrement orbitalaire sp²-sp² (recouvrement axial). Parallèlement, les orbitales pz non hybridées peuvent se recouvrir latéralement, en formant une liaison π (recouvrement latéral). Il en résulte une double liaison.
I.5.3- Hybridation sp
Le carbone peut également former des triples liaisons par la mise en commun de six électrons.
C’est notamment le cas de la molécule d’acétylène, molécule linéaire qui possède une triple liaison.
Dans ce cas d’hybridation, l’orbitale s se combine avec une seule orbitale p. Il en résulte deux orbitales hybrides sp et deux orbitales py et pz inchangées. Chaque orbitale hybride contenant un électron, la seule façon de minimiser les répulsions électroniques est l’alignement de ces deux orbitales, formant entre elles un angle plat de 180°.
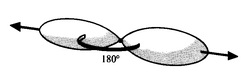
Lorsque deux carbones hybridés sp se rapprochent, ils peuvent former une liaison σ forte par recouvrement orbitalaire sp-sp (axial). De plus, les orbitales py et pz non hybridées peuvent se recouvrir latéralement, en formant deux liaisons π. Il en résulte une triple liaison.
II- Représentation des molécules
II.1- Formule brute
La formule brute d’une molécule la nature et le nombre des différents atomes constituant cette molécule.
On peut, à partir de la formule brute d’une molécule, déterminer le nombre d’insaturations ou de cycles (indice de déficience en hydrogène), noté I, à partir de la formule suivante :
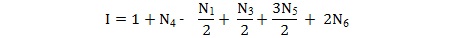
41356
N1 : nombre d’atomes monovalents
N3 : nombre d’atomes trivalents
N4 : nombre d’atomes tétravalents
N5 : nombre d’atomes pentavalents
N6 : nombres d’atomes hexavalents
Exemple : L’acétone a pour formule brute C3H6O :
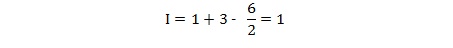
II.2- Formule développée et semi-développée
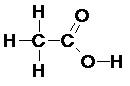
La formule développée correspond à la représentation de l’ensemble des liaisons covalentes entre atomes de la molécule par des tirets.
Exemple :
II.3- Formule semi-développée
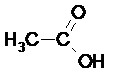
La formule semi-développée correspond à une simplification de la formule développée dans laquelle les liaisons C-H ne sont pas représentées.
Exemple :
II.4- Schéma de Lewis
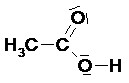
Cette représentation a été détaillée précédemment (voir I.2). Il s’agit d’une formule développée sur laquelle on a également représenté les doublets non liants des hétéro-atomes.
Exemple :
II.5- Formule topologique
La formule topologique est la représentation de la chaîne carbonée par des lignes brisées. Les atomes de carbone et d’hydrogène liés à ces derniers ne sont pas représentés. Chaque extrémité de segment correspond à un atome de carbone lié au nombre d’atomes d’hydrogène nécessaire pour assurer la tétravalence du carbone. Les hétéroatomes et les atomes d’hydrogène liés à ceux-ci, ainsi que les liaisons multiples sont en revanche représentés.
Exemple :
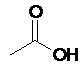
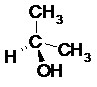
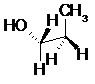
II.6- Représentation de Cram
Il s’agit de la représentation dite en « coins volants ». Le code utilisé pour cette représentation est le suivant :
-  : liaison entre 2 atomes dans le plan
: liaison entre 2 atomes dans le plan
-  : liaison entre un atome du plan et un atome en avant du plan
: liaison entre un atome du plan et un atome en avant du plan
- : liaison entre un atome du plan et un atome en arrière du plan (parfois représentée ainsi :
: liaison entre un atome du plan et un atome en arrière du plan (parfois représentée ainsi :  )
)
Exemples :
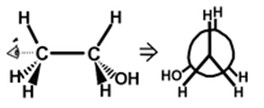
II.7- Représentation de Newman
On place le regard dans l’axe de la liaison entre deux atomes successifs.
L’atome de devant est représenté par un point, celui en arrière est masqué par le premier, on le représente par un cercle.
Les liaisons issues des deux atomes sont projetées sur un plan perpendiculaire à l’axe de la liaison référence : les liaisons de l’atome le plus proche de l’observateur sont représentées par des segments partant du centre du cercle, celles de l’atome le plus éloigné sont symbolisées par des segments radiaux qui s’arrêtent à la périphérie du cercle.
Exemples :
II.8- Représentation perspective
C’est la représentation en perspective cavalière. Les liaisons parallèles sont représentées par des segments parallèles. Cette représentation est surtout utilisée pour le cyclohexane et ses dérivés.
Exemple :
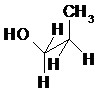
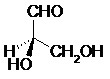
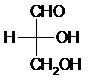
II.9- Projection de Fisher
La projection de Fisher est une représentation plane d’une molécule organique.
La chaîne carbonée principale est placée à la verticale, le carbone le plus oxydé est placé en haut (les liaisons de cet axe sont en réalité dans le plan ou vers l’arrière du plan).
Les liaisons situées vers l’avant du plan sont représentées par des traits horizontaux.
Exemple :
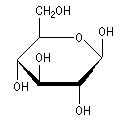
II.10- Représentation de Haworth
Il s’agit de la représentation cyclique des oses (sucres). Le cycle est représenté par un hexagone, dont on épaissit le trait des liaisons du cycle en avant du plan.
Exemple :
III- Nomenclature en chimie organique
III.1- Hydrocarbures
Les hydrocarbures sont des molécules organiques composées uniquement d’atomes de carbone et d’hydrogène. Il existe différents types d’hydrocarbures.
III.1.1- Alcanes
Les hydrocarbures à chaîne saturée constituent la famille des alcanes. Les atomes de carbone sont tous de type sp3. On distingue 2 types d’alcanes :
- Les alcanes aliphatiques (linéaires ou ramifiés) de formule brute CnH2n+2.
- Les alcanes cycliques de formule brute CnH2n.
Le nom des alcanes est formé du nom de la chaîne principale qui indique le nombre d’atomes de carbone et du suffixe « -ane ». Pour les alcanes cycliques on ajoute le préfixe « cyclo-» devant le nom.
Exemples :
Alcane linéaire Alcane ramifié Alcane cyclique
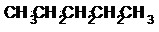
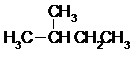
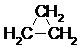
ou ou ou
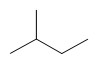
III.1.2- Alcènes - Alcynes
Lorsqu’un hydrocarbure aliphatique possède des atomes de carbone hybridés sp² ou sp, on parle d’hydrocarbure insaturé (présence de liaisons multiples).
- Dans le cas d’atomes hybridés sp² (liaisons doubles), on parle d’alcène, de formule brute CnH2n.
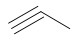
- Dans le cas d’atomes hybridés sp (liaisons triples), on parle d’alcyne, de formule brute CnH2n-2.
La dénomination des alcènes et des alcynes est analogue à celle des alcanes. Le nom des alcènes se termine en « -ène » et celui des alcynes se termine en « -yne ». La désinence « -éne » devient « -én-» lorsqu’elle est suivie d’une voyelle autre que e.
Exemples :
Alcène
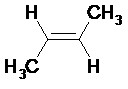
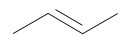
Alcyne
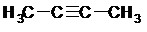
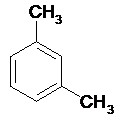
II.1.3- Arènes
Les arènes sont les hydrocarbures aromatiques. La plupart des arènes monocycliques ont conservé leur nom usuel, les autres sont nommés en tant que dérivés du benzène. Dans le cas d’un noyau benzénique disubstitué, on fait appel à la nomenclature « ortho », « méta » ou « para ».
- si les substituants sont en position 1,2 on parle de position « o-» pour « ortho ».
- si les substituants sont en position 1,3 on parle de position « m -» pour « méta ».
- si les substituants sont en position 1,4 on parle de position « p-» pour « para ».
Lorsque le benzène est un substituant, il est appelé « phényle », noté « Ph».
Le groupement Ph-CH2- est appelé « benzyle ».
Du fait de leur complexité, les hydrocarbures aromatiques polycycliques conservent leurs noms usuels.
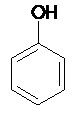
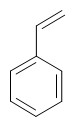
Exemples :
Phénol Styrène m-xylène
III.2- Goupes fonctionnels
Un groupe fonctionnel est un atome ou groupe d’atomes appartenant à la chaîne carbonée principale. Les principales fonctions sont répertoriées dans le tableau suivant :
|
Fonctions |
Formule |
|
|
Acide carboxylique |
-CO2H |
|
|
Ester |
-CO2R |
R ≠ H |
|
Chlorure d’acide |
-CO2Cl |
|
|
Anhydride d’acide |
-CO |
|
|
Amide |
-CONR2 |
R= H , alkyle |
|
Nitrile |
-CN |
|
|
Aldéhyde |
-CHO |
|
|
Cétone |
-CO- |
|
|
Alcool |
-OH |
|
|
Phénol |
Ph-OH |
|
|
Thiol |
-SH |
|
|
Amine |
-NR2 |
R= H, alkyle |
|
Halogénure d’alkyle |
R-X |
X = F, Cl, Br, I |
|
Organométallique |
R-M |
M = Li, Na,… |
|
Ether-oxyde |
R-O-R’ |
R, R’ = alkyle |
|
Thioéther |
R-S-R’ |
R,R’ = alkyle |
III.3- Règles de nomenclature
Les règles de nomenclature systématique ont été établies par l’UICPA ( Union Internationale de Chimie Pure et Appliquée).
III.3.1- Généralités
Le nom d’un composé organique peut généralement se décomposer de la façon suivante :
Substituants + Chaîne Carbonée Principale + Insaturations + Fonction Principale
(Préfixe) (Suffixe)
La dénomination d’un composé organique implique les opérations suivantes, effectuées dans l’ordre indiqué :
1°- Recherche de la fonction principale, désignée par le suffixe. Tous les substituants (y compris les autres fonctions) seront désignées par des préfixes. Un ordre de priorité a été établi pour classer les fonctions dans le cas d’un composé polyfonctionnel.
Acide Carboxylique > Anhydride > Ester > Halogénure d’Acide >Amide > Nitrile > Aldéhyde > Cétone > Alcool > Phénol > Amine > Ether-Oxyde
Certaines fonctions sont toujours désignées par un préfixe : chloro (Cl), nitro (NO2), nitroso (NO), …
2°- Recherche de l’unité structurale fondamentale comportant obligatoirement dans l’ordre :
- la fonction principale
- le maximum possible de liaisons multiples
- la chaîne carbonée la plus longue
- le maximum possible de substituants
3°- Dénomination de la chaîne principale et des insaturations selon la nomenclature des hydrocarbures (alcanes, alcènes, alcynes).
4°- Ajout du suffixe correspondant à la fonction principale.
|
Fonction |
Formule |
Préfixe |
Suffixe |
|
Acide carboxylique |
-CO2H |
-carboxy |
Acide …oïque |
|
Ester |
-CO2R |
- |
-oate d’alkyle |
|
Amide |
-CONR2 |
- |
-amide |
|
Nitrile |
-CN |
-cyano* |
-nitrile |
|
Aldéhyde |
-CHO |
-formyl* |
-al |
|
Cétone |
-CO- |
-oxo |
-one |
|
Alcool |
-OH |
-hydroxy |
-ol |
|
Amine |
-NR2 |
-amino |
-amine |
|
Ether-oxyde |
R-O-R’ |
-oxa / -alkyloxy** |
|
*Carbones fonctionnels non comptabilisés dans la numérotation de la chaîne principale.
**Oxygène compté dans la chaîne carbonée.
5°- Détermination et dénomination des substituants, en tant que préfixes.
Nomenclature de groupes alkyle (-CnH2n+1) :
|
Nombre d’atomes de carbone |
Nom du Groupement alkyle |
|
1 |
Méthyle (Me) |
|
2 |
Ethyle (Et) |
|
3 |
Propyle (Pr) |
|
4 |
Butyle (Bu) |
|
5 |
Pentyle |
|
6 |
Hexyle |
|
7 |
Heptyle |
|
8 |
Octyle |
|
9 |
Nonyle |
|
10 |
Décyle |
6°- Numérotation (cf. II.2).
7°- Assemblement des noms partiels en un nom complet en rangeant les préfixes (précédés de leurs indices) dans l’ordre alphabétique.
III.3.2- Numérotation de la chaîne principale
1°- Le carbone fonctionnel (portant fonction principale) a la priorité pour l’attribution de l’indice le plus bas.
2°- Dans le cas des alcènes et des alcynes ne possédant pas de groupement fonctionnel, la chaîne carbonée est numérotée de manière à ce donner les indices les plus bas possibles aux insaturations. Les triples liaisons sont prioritaires sur les doubles liaisons.
3°- Pour les alcanes ne possédant pas de groupement fonctionnel, la plus longue chaîne est numérotée de façon à ce que l’ensemble des indices des substituants soit le plus bas possible. Ces indices sont placés avant la partie du nom à laquelle ils se réfèrent.
Exemple :
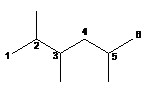 2,3,5-triméthylhexane et non 2,4,5-triméyhylhexane
2,3,5-triméthylhexane et non 2,4,5-triméyhylhexane
Si plusieurs substituants occupent la même position, celle qui recevra l’indice le plus bas sera celle énoncée en premier dans l’ordre alphabétique.
Exemple :
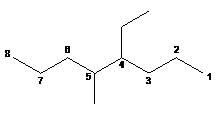 4-éthyl-5-méthyloctane
4-éthyl-5-méthyloctane
Les préfixes multiplicateurs ne sont pas pris en compte dans cet ordre alphabétique.
Exemple :
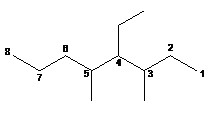 4-éthyl-3,5-diméthyloctane
4-éthyl-3,5-diméthyloctane
Application :
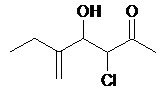
Fonction principale : cétone
Unité fondamentale :
- fonction cétone : suffixe -one
- double liaison : désinence -én- car suivie d’un o
- chaîne carbonée à 6 atomes de carbone : hex-
Il s’agit d’une hexénone
Substituants :
-Cl : Chloro
-OH : hydroxy
-CH2CH3 : éthyl
Numérotation : La fonction prioritaire porte l’indice le plus bas : l’atome de carbone portant la fonction cétone est donc le numéro 2.
Le nom complet du composé est donc : 3-chloro-5-éthyl-4-hydroxy-hex-5-én-2-one
